ΤΟ ΝΕΡΟ ΚΑΙ ΟΙ ΑΛΛΕΣ ΟΥΣΙΕΣ. Μέρος 1ο. Το νερό στη Γη. Η ιδιαίτερη συμπεριφορά του νερού σε επιφανειακή τάση, ικανότητα διάλυσης, Σημείο ζέσεως και τάση ατμών
Δήμητρα Σπανού, Χημικός, καθηγήτρια Β/θμιας Εκπαίδευσης με οργανική θέση στο 1ο Γυμνάσιο Δάφνης
ΤΟ ΝΕΡΟ ΠΑΝΤΟΥ
Το νερό είναι η περισσότερο διαδεδομένη ουσία στην Γη καλύπτοντας το 70,9% της επιφάνειάς της ενώ ταυτόχρονα βρίσκεται σε αέρια καάσταση (υδρατμοί) και σε στερεά (πάγος). Νερό.
Tο νερό στη Γη παίζει πρωταρχικό ρόλο στην κυκλοφορία ύλης και ενέργειας, στην προέλευση και διατήρηση της ζωής, στην χημική δομή των ζωντανών ογανισμών και στην διαμόρφωση του κλίματος.
Νερό υπάρχει και αλλού στο ηλιακό μας σύστημα όπως σε ορισμένους δορυφόρους του Δία και του Κρόνου, αλλά ακόμα και στον ήλιο έχει ανιχνευτεί νερό αλλά και σε πολλούς πλανήτες του Ηλιακού μας συστήματος (Άρης, Αφροδίτη, Ερμής, Δίας, Κρόνος κ.α.) υπάρχουν υδρατμοί.
Υγρό νερό βρέθηκε πρόσφατα στην επιφάνεια του Άρη αλλά και κάτω από την επιφάνεια Θεωρείται δε πιθανόν, να υπάρχει νερό και σε άλλους Γαλαξίες.
Πάγος στο ηλιακό μας σύστημα, εκτός από τη Γη υπάρχει και στον Άρη, την Σελήνη, σε δορυφόρους του Κρόνου, στον Κρόνο, Πλούτωνα, κομήτες και αλλού.
Πολύ από το νερό στο Σύμπαν έχει παραχθεί σαν παραπροϊόν του σχηματισμού των άστρων στα θερμά πυκνά αέρια που παράγονται κατά τη γέννησή τους. Το 2011 λ.χ. αναφέρθηκε η ύπαρξη ενός νέφους με γιγαντιαία ποσότητα από υδρατμούς σε ένα κβαζαρ (κέντρο γαλαξία) 12 δισεκατομύρια έτη φωτός από τη Γη.
Έτσι, μια από τις θεωρίες της ύπαρξης του νερού στη Γη είναι ότι, αυτό προέρχεται από τα άστρα ίσως να ήταν μια γιγαντιαία χιονόμπαλα από το διάστημα, αφού ακόμα και σήμερα, η βομβαρδίζεται από τέτοιες.
Το συνολικό νερό στη Γη είναι 1.358.099.876 km 3
ΤΟ ΝΕΡΟ ΣΑΝ ΧΗΜΙΚΗ ΟΥΣΙΑ
Το νερό είναι μια χημική ουσία που αποτελείται από Υδρογόνο και Οξυγόνο. Στην πραγματικότητα το υδρογόνο είναι μείγμα ουσιών που σχηματίζονται από συνδυασμό τριών ισοτόπων του Υδρογόνου του Δευτέριου και του Τρίτιου και άλλων τριών ισοτόπων του Οξυγόνου.
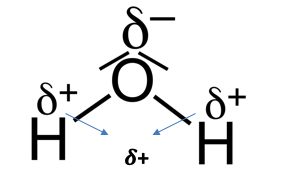
Η σύνδεση του οξυγόνου με το υδρογόνο είναι ομοιοπολικής φύσης όμως η ηλεκτραρνητικότητα του οξυγόνου (3,5) είναι μεγαλύτερη από του υδρογόνου (2,2) κι έτσι ο δεσμός εμφανίζει πολικότητα.
Σε αυτό οφείλεται και η διαφορετική τιμή στις γωνίες που σχηματίζονται μεταξύ των H-O γωνίων O-H (255,55o) και H-O και O-H (104,45o)

Ο πολικός χαρακτήρας του μορίου με το οξυγόνο δ- και το υδρογόνο δ+ ,έχει σαν αποτέλεσμα τις διαμοριακές συνδέσεις και την συνένωση δύο ή περισότερων μορίων με δεσμούς υδρογόνου. Υπάρχει δηλαδή μια έλξη ανάμεσα σε ένα άτομο υδρογόνου δεσμευμένου σε ένα μόριο νερού και ενός ζεύγους ηλεκτρονίων του οξυγόνου άλλου μορίου, πράγμα που αποτελεί μια διαμοριακή σύνδεση. Κάθε μόριο νερού σχηματίζει έως και 4 δεσμούς υδρογόνου αποκτώντας έτσι διακλαδισμένη δομή των μορίων του.
Η ενέργεια της σύνδεσης μορίων διμερούς νερού μεταξύ τους μέσω δεσμών υδρογόνου είναι
0,2ev ή 5kcal/mol και αυτή είναι μεγαλύτερη από την ενέργεια θερμικής κίνησης των μορίων του σε θερμοκρασία 300οΚ αλλά πολύ μικρότερη από την ενέργεια των ομοιοπολικών του δεσμών.
Οι δεσμοί υδρογόνου κάνουν το νερό να μετατρέπεται σε ένα υπερμόριο (και εκεί οφείλονται οι εξαιρετικές ιδιότητες που έχει) αλλά με σχετικά αδύναμες τις συνδέσεις που μπορεί να εξαφανιστούν σε υψηλή θερμοκρασία!).
Σε αυτούς όμως οφείλεται επίσης και η θερμική ικανότητα του νερού (υψηλή θερμοχωτικότητα) όπως και θερμική αγωγιμότητα, η επιφανειακή τάση, η υψηλή πυκνότητα σε υγρή μορφή, διαλυτική ικανότητα.
ΟΙ ΙΔΙΑΙΤΕΡΕΣ ΙΔΙΟΤΗΤΕΣ ΤΟΥ ΝΕΡΟΥ
ΔΙΑΛΥΤΙΚΗ ΙΚΑΝΟΤΗΤΑ

 Η έντονη πολικότητα του νερού δεν κάνει μόνο την συνδεση των πολικών μορίων του μεταξύ τους με μοριακούς δεσμούς υδρογόνου αλλά την δημιουργία αντίστοιχων δεσμών υδρογόνου με μόρια που διαθέτουν άτομα που επίσης δημιουργούν δεσμούς υδρογόνου όπως το Οξυγόνο, το Αζωτο και το Φθόριο.
Η έντονη πολικότητα του νερού δεν κάνει μόνο την συνδεση των πολικών μορίων του μεταξύ τους με μοριακούς δεσμούς υδρογόνου αλλά την δημιουργία αντίστοιχων δεσμών υδρογόνου με μόρια που διαθέτουν άτομα που επίσης δημιουργούν δεσμούς υδρογόνου όπως το Οξυγόνο, το Αζωτο και το Φθόριο.
Ακόμα το νερό κάνει σύνδεση με άλλα πολικά μόρια (όπως αμμωνία, αλκοόλες,οξέα κ.α.) και ιόντα (NaCl) . Για αυτόν τον λόγο αποτελεί έναν εξαιρετικό διαλύτη κυρίως ανοργάνων αλλά και οργανικών ουσιών.

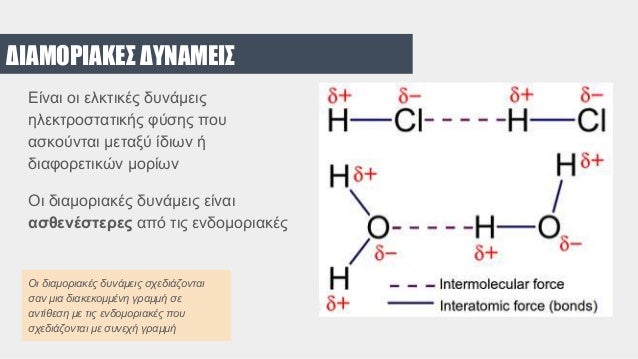
Σε ανάμειξη του νερού με άλλα πολικά μόρια, τα θέτικά τμήματα των μορίων αυτών προσελκύουν άτομα οξυγόνου και τα αρνητικά άτομα υδρογόνου (Hcl, ΝΗ3). Επειδή τα μόρια νερού είναι μικρά, πολλά μόρια μπορούν να περιβάλουν το κάθε μόριο διαλυμένης ουσίας, με αποτέλεσμα να τροποποιούν συχνά τις ιδιότητές της.
Η διαλυτική ικανότητα του νερού μειώνεται σε περιπτώσεις ιοντικών ενώσεων με ισχυρή σύνδεση μεταξύ τους (όπως πολλά υδροξείδια) και σε περιπτώσεις οργανικών μη πολικών ουσιών όπως λίπη, κηροί
ΕΠΙΦΑΝΕΙΑΚΗ ΤΑΣΗ ΣΤΟ ΝΕΡΟ

Η έννοια της επιφανειακής τάσης
Η επιφανειακή τάση στα υγρά οφείλεται στο ότι, στην επιφάνεια υγρών έχουμε διαφορετική συμπεριφορά από ότι το εσωτερικό του, όσον αφορά τις δυνάμεις μεταξύ των μορίων, εφόσον οι δυνάμεις van der Walls δεν ασκούνται ισόρροπα στην επιφάνεια του υγρού και στο εσωτερικό του γιατί τα μόρια την επιφάνεια δεν περιβάλονται με νερό από όλες τις πλευρές. Αποτέλεσμα είναι στην επιφάνεια οι διαμοριακές δυνάμεις γύρω από τα μόρια να μην εξισορροπούνται και η τελική συνισταμένη δύναμη στην επιφάνεια να είναι διάφορη από το μηδέν .
Η επιφανειακή τάση έχει διπλή φυσική σημασία, α. ενεργειακή (θερμοδυναμική) και δυναμική (μηχανική)
Ενεργειακή ερμηνεία: Εφόσον στην επιφάνεια των υγρών συνολικά ασκείται δύναμη, η δυναμική ενέργεια στην επιφάνεια εμφανίζεται αυξημένη. Έτσι, τα μόρια του υγρού, για να μειώσουν αυτήν την επιπλέον ενέργεια, τείνουν να αυξήσουν την έκταση της επιφάνειας του υγρού, ώστε το παραγόμενο έργο να απορροφήσει την ενέργεια αυτή και το σώμα να φτάσει σε χαμηλότερο ενεργειακό επίπεδο, όπου έχει μεγαλύτερη σταθερότητα. Η επιφανειακή τάση είναι το συγκεκριμένο έργο της αύξησης της επιφάνειας .
Σε μεγάλες ποσότητες η βαρύτητα εμποδίζει την δημιουργία σφαιρών.
Γενικότερα, η δημιουργία επιφάνειας σε ένα υγρό, απαιτεί την καταβολή έργου και παραπέρα έκταση της επιφάνειας αυτής, απαιτεί πρόσθετο έργο.
Δυναμική (μηχανική) σημασία: 
Τα μόρια στην επιφάνεια ενός ρευστού δέχονται ανισόρροπα δυνάμεις από τις διαμοριακές συνδέσεις στην επιφάνεια από ότι στο εσωτερικό
Η επιφάνειά τους δέχεται ακόμα την πίεση της ατμόσφαιρας, και η συνολική δύναμη από τις διαμοριακές συνδέσεις στην επιφάνεια δεν είναι ικανή να εξισορροπήσει την ατμοσφαιρική πίεση, (που οφείλεται δύναμη από το βάρος των υπερκείμενων στρωμάτων της ατμόσφαιρας). Η ατμοσφαιρική Πίεση ασκείται κάθετα στην επιφάνεια του υγρού, ανά μονάδα στοιχειώδους επιφάνειας του υγρού dSi και φυσιολογικά δεν εξισορροπείται για τους λόγους που αναφέρθηκαν.
Εάν όμως, επιφάνεια του υγρού καμπυλωθεί η δυνάμη από το βάρος της ατμόσφαιρας (ατμοσφαιρικη πίεση) δεν προσπίπτει πλέον κάθετα στα διάφορα σημεία της καμπυλωμένης επιφάνειας, αλλά υπό γωνία αλλά σε κάθε μια από αυτές προσμετράται η συνιστώσα στο καμπυλωμένο επίπεδο! Η συνιστώσα αυτή είναι μειωμένη ανάλογα με την γωνία πρόσπτωσης. Η συνολική δύναμη που δέχεται η επιφάνεια γίνεται μικρότερη κι έτσι η πίεση εξισορροπείται.
Σύμφωνα με αυτήν ο υπολογίζεται η επιφανειακή τάση ορισμός της επιφανειακής τάσης είναι: Επιφανειακή τάση επιφάνειας υγρού είναι η δύναμη που ασκείται ανά μονάδα μήκους μιας γραμμής που οριοθετεί την επιφάνεια ενός ρευστού
Στο νερό, η επιφανειακή τάση εμφανίζεται αυξημένη γιατί λόγω της έλξης των μορίων του νερού μεταξύ τους και κυρίων μέσω των δεσμών υδρογόνου οι εσωτερικές ελκτικές δυνάμεις που ασκούνται στα μόρια της επιφάνειας είναι αυξημένες. Η επιφανειακή τάση του νερού είναι 72,8 mN ανά m2 στους 20oC
ΤΟ ΙΞΩΔΕΣ ΚΑΙ Η ΡΕΥΣΤΟΤΗΤΑ ΤΟΥ ΝΕΡΟΥ
Το Ιξώδες ενός υγρού, δηλαδή η ανεξάτητη ροή υγρού κάτω από μια σταθερή επιφάνεια, οφείλεται στην
διαφορά της δομής στην επιφάνεια και στο εσωτερικό ενός υγρού υπό ορισμένες συνθήκες. Δηλαδή εμφανίζεται μια διαφορά στην ταχύτητα κίνησης μεταξύ διαφόρων στρωμάτων ενός υγρού, λόγω της διαφοράς των δυνάμεων που ασκούνται σε κάθε στρώμα.
Διακρίνουμε το Δυναμικό ιξωδες που είναι την αντίσταση του υγρού στη μετατόπιση ενός στρώματος σε σχέση με ένα άλλο
Το δυναμικό ιξώδες μειώνεται με την αύξηση της θρμοκρασίας και αυξάνεται με την αύξηση της πίεσης
το κινηματικό ιξώδες που είναι ο λλόγος του Δυναμικού προς την πυκνότητα και σχετίζεται με την ταχύτητα ροής
και το απολυτο ιξώδες
Το ιξώδες του νερού είναι αρκετά υψηλό (0, 01012cm2/sec στους 20ο C ) και αυτό επίσης οφείλεται στο γεγονός ότι οι δεσμοί υδρογόνου εμποδίζουν τα μόρια του νερού να κινούνται με διαφορετικές ταχύτητες. Στους 100oC το ιξώδες μειώνεται στους 0, 0028cm2/sec
(νόμος της Ιξώδους ροής)
ΣΗΜΕΙΟ ΖΕΣΕΩΣ ΚΑΙ ΤΑΣΗ ΑΤΜΩΝ ΝΕΡΟΥ
Το νερό σε κανονικές θερμοκρασίες περιβάλλοντος είναι υγρή ουσία το δε Σημειο Βρασμού είναι στους 100οC πράγμα που δεν αναμένεται για μια ουσία με ένα τόσο μικρό μόριο. Μόρια αντίστοιχου μεγέθους και χημικής δομή (H2S, CH4, HF...) σε θερμοκρασία περιβάλλοντος είναι αέρια με αντίστοιχα σημεία βρασμού -60,28οC -161,6οC 19,5οC. Αυτό οφείλεται βέβαια στο πολυμερικό του χαρακτήρα λόγω των δεσμών υδρογόνου και της διακλαδισμένης σύνδεσης που αναπτύσσονται μεταξύ των μορίων του. Εάν δεν υπήρχαν οι δεσμοί υδρογόνου το νερό, ανάλογα με την θέση του οξυγόνου στον περιοδικό πίνακα θα είχε Σημείο Ζέσεως 80οC και Σημείο Πήξεως -100οC περίπου, ανάλογα με παρόμοια υδρίδια στοιχείων που μοιάζουν με οξυγόνο.
ΤΑΣΗ ΑΤΜΩΝ

Μόρια υγρού των οποίων η κινητική ενέργεια υπερβαίνει τις δυνάμεις συνοχής (διαμοριακές κ.α.) περνούν από την υγρή στην αέρια φάση (ατμός) Τα μόρια του αερίου διαλύονται στον ατρμοσφαιρικό αέρα στον οποίον περιέχονται στη συνέχεια .
Υδρατμοί στον ατμοσφαιρικό αέρα προέρχονται από ελεύθερες επιφάνει ες υγρών ή στερεών.
Αν η ποσότητα των υδρατμών αυτών φτάσει την μέγιστη την οποία μπορεί να διαλύσει ο ατμοσφαιρικός αέρας τότε βρίσκεται σε σημείο κόρου και ονομάζεται κορεσμένος.
Οι υδρατμοί στον κορεσμένο αέρα (αλλά και στον μη κορεσμένο) βρίσκονται σε μια δυναμική κατάσταση με το υγρό ή το στερεό από όπου έχουν προέλθει και διαρκώς μόρια από την υγρή ή στερεά φάση περνούν στην αέρια φάση και αντίστροφα, μόρια από τους ατμούς περνούν στην υγρή φάση.
Η πίεση των ατμών αυτών λόγω της θερμικής τους κίνησης λέγεται τάση ατμών και εξαρτάται από την θερμοκρασία
Όταν αυτή εξισώνεται με την ατμοσφαιρική πίεση, το υγρό περνά μαζικά στην αέρια φάση (βρασμός). Είναι προφανές ότι εάν η ατμοσφαιρική ή άλλη εξωτερική πίεση εμφανιστούν αυξημένες, η θερμοκρασία Βρασμού αυξάνεται

ΠΗΓΕΣ
Νερό - Βικιπαίδεια (wikipedia.org)
ΧΗΜΕΙΑ ΚΑΙ ΚΑΘΗΜΕΡΙΝΗ ΖΩΗ Α. Βάρβογλη
Intermolekulare Kräfte - lernen mit Serlo!
Δεσμοί υδρογόνου - Βικιπαίδεια (wikipedia.org)
img_user_file_561aa2f0d932f_10
https://studref.com/563842/matematika_himiya_fizik/vodorodnaya_svyaz
Νερό: Ιδιότητες, Σημασία, Πίνακας (helpdoma.ru)
Τι είναι η επιφανειακή τάση; Ορισμός και Αιτίες (greelane.com)
Νερό - Βικιπαίδεια (wikipedia.org)
Wasserläufer_bei_der_Paarung_crop.jpg (1227×1023) (wikimedia.org)
Επαφή
Καισαριανή- Αθήνα
16121
*306942806171
302114143389 dimspa57@hotmail.com . spanudimitra@gmail.com
